
服务热线

脑科学是目前国际前沿科技的热点研究领域之一,对脑功能的研究有助于理解人类认知、情感等复杂生理过程的本质,以及神经系统疾病的形成和发展规律。脑神经信号的传递以及代谢过程都离不开化学物质的参与,因此,针对脑内神经递质、调质、能量代谢物质、自由基、离子等诸多神经化学物质开展脑神经分析化学研究,对于探索和认识神经生理、病理的分子机制,都具有极其重要的意义。脑神经化学物质的分析一般分为单囊泡、单细胞、脑片及活体水平分析等多个层次。其中,单囊泡、单细胞及脑片层次上进行化学物质检测脱离了活体生存的真实环境,较难保持细胞之间固有的联系和相互作用。相比较而言,活体层次对脑化学物质进行分析,能够更加真实、直接地反映神经系统在各种生理、病理过程中对外界刺激的响应,因而能够为脑神经生理、病理过程物质基础的探索提供最为直接的信息。电化学分析方法通常具有灵敏度高、选择性好、时空分辨率高等优点,且检测电极易于微型化,非常适用于活体原位分析测定。活体原位电化学分析方法可应用于脑内不同化学物质基础水平及其在一系列生理、病理过程中浓度变化的监测。活体原位电化学分析可追溯到20世纪50年代,Clark 等[1]人利用玻璃封装的铂丝作为研究电极,首次通过电化学伏安法实现了脑内氧气浓度变化的实时监测。更为人们熟知的是,1973年 Adams [2]等人首次将微型化碳糊电极植入大鼠脑中进行活体电化学研究,得到了脑神经物质的在电极上的电化学反应信号,进一步验证了电化学方法在脑内实现生理活性物质检测的可行性,引起了神经生理学家的高度关注,标志着活体原位脑神经电化学分析的诞生。
近年来,随着分析科学、化学、电子科学、神经科学等多学科的快速发展和交叉融合,脑神经活体原位电化学分析也不断发展完善,为相关生理、病理过程研究提供了重要的实验方法,进一步推动了分析化学与脑神经科学的实质性交叉与融合。本文选取其中一种使用广泛的活体原位电分析化学方法,快速扫描循环伏安法(FSCV),着重介绍其原理、特点及在脑神经化学研究中应用的进展,并对其发展趋势进行展望。FSCV:FSCV 是一种具有高时间分辨率的电势扫描伏安法。以碳纤维微电极作为研究电极,并以一定频率施加大于100 V / s 扫速的三角波进行循环伏安分析,可达到毫秒级的时间分辨率[3]。在 FSCV 分析中,随着电位扫描速度的增加,电化学反应动力学较慢的物质将表现得更不可逆,其氧化还原峰偏移程度大于电化学反应速度较快的电活性物质,从而实现对不同电极过程动力学的物质进行区分。FSCV 与常规扫速(1 ~ 500 mV / s) 下的循环伏安法不同,电位扫描过程中,由于双电层充放电电流与扫速成正比,而法拉第电流与扫速的平方根成正比。因此,高扫速下,循环伏安曲线中双电层充放电所贡献的非法拉第电流会明显增大,并成为能记录到的总电流的主要组成部分,影响对目标分析物氧化还原过程法拉第电流的提取。通常,FSCV 的结果会以变化前某一特定周期的 FSCV 数据作为背景进行扣除,以便降低背景电流的影响[4]。扣除背景后的 FSCV 结果可进行定性和定量分析。但是,由于背景扣除过程所扣除的一般是固定的循环伏安数据,这将导致在长时间电化学分析中双电层结构变化所造成的背景电流漂移不断积累,对分析结果产生较大影响。因此,该方法持续分析时间通常约几分钟,不宜进行长时间的连续分析。
目前,FSCV 方法应用较为成熟的测定体系是对脑内儿茶酚胺类神经递质(尤其是多巴胺)快速变化过程的原位实时分析[5]。活体分析过程中,在每个施加的三角波之间通常会将研究电极维持在负电位(如-0.4V)下,利于儿茶酚胺类物质在电极表面的富集,从而提高检测的灵敏[6]。同时,带负电的物质不会得到富集,在一定程度上也提高了FSCV 对儿茶酚胺类物质检测的选择性。在高扫速下,多巴胺等具有较快电子转移速率的电化学活性物质的氧化还原电流得到大幅提高;另一方面也使得抗坏血酸等电子转移速度相对较慢的干扰物质在电极上表现得更不可逆,其氧化峰正移,进而实现对多巴胺等物质的选择性检测[7,8]。FSCV 方法虽然具有良好的选择性和灵敏度,并能够实现高时间分辨但由于脑神经系统中多种电化学活性生理物质具有相近的氧化电位,导致产生的氧化还原电流相互交叠,不容易区分与精准定量。因此,早期的 FSCV 方法主要用作神经化学过程中电化学活性物质的定性和半定量研究。Wightman等[9]利用不同颜色代表不同电流值,将一组 FSCV 数据拼合绘制成“电位—时间—电流”二维图,即可通过二维图中不同的图案直观地看出不同时间不同电化学活性物质浓度的变化过程,为人们研究复杂生理病理过程中物质的变化提供了可能。采用 FSCV 方法进行定量分析时,通常在目标分析物 FSCV 结果中选取氧化还原电流较大,且无其它物质干扰电位下的电流值,以此绘制出电流随时间变化的曲线,或根据线性关系换算为浓度-时间曲线。然而,这种方法在多种物质变化的复杂体系中存在很大的局限性。为了解决FSCV 方法在复杂体系中的定量问题,Heien 等[10]将主成分回归(Principal component regression,PCR) 应用于多种物质变化的复杂体系下 FSCV 结果的定量分析。他们发现,多巴胺的 FSCV 波形与不同 pH 值造成的FSCV 波形变化有明显差异,采用主成分回归方法可将FSCV 波形中多巴胺的氧化还原波形和 pH 值造成的波形变化进行有效地区分,并逐渐发展出多巴胺和pH 值双组分同时测定的方法[11,12]。随后,Heien 等[13]利用该方法研究了可卡因对尾状核脑区多巴胺释放的调控,以及该过程中的pH 值变化(图 3C)。
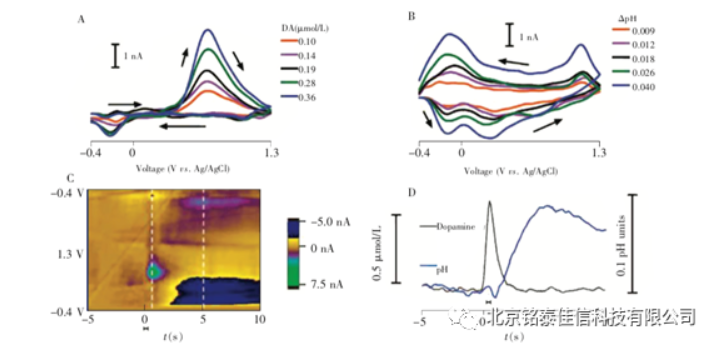
图 1、FSCV 用于同时检测多巴胺和 pH 变化 (A) 不同浓度多巴胺的FSCV 波形;(B) 不同pH 条件引起的 FSCV 波形变化[11];(C)SD 大鼠电刺激多巴胺释放过程 FSCV二维图以及该过程中多巴胺和pH 值的变化结果[13];(D)使用主成分回归分析得到的多巴胺和 pH 的变化结果。
在FSCV 分析时,主成分回归方法虽然可用于解决多种神经化学物质的区分和定量问题,但由于双电层变化导致的背景电流漂移却无法通过主成分回归消除。为了使主成分回归算法计算结果真实有效,FSCV方法应用于活体分析的持续时间通常短于90 s [11]。很多研究组也通过优化FSCV 分析中所使用的电极和数据处理方法,使其能够进行长时间的活体分析。如Clark 等[14]将直径7微米的碳纤维封装在直径90微米的熔融玻璃毛细管中,发现电极尺寸的减小可明显降低其对脑组织的损伤并减少免疫反应,从而使电极具有良好的生物兼容性。利用此电极,实现了对脑内多巴胺长达10 ~ 16 周的活体分析。Schwerdt 等[15]进一步优化了长时间记录时FSCV 的数据处理方法,通过将持续记录的 FSCV 数据分割成多个50 s 时长,分别进行主成分回归分析,再将分析结果拼合即可得到较长时间的检测结果,最终实现了使用长期植入阵列电极进行非人灵长类动物脑内多巴胺变化的长时程监测。[16]而为了获取更加准确的活体内多巴胺浓度变化数据,电极的检测性能也在不断的进行优化,例如电极虽然尺寸小,植入脑内不易造成局部组织的炎症反应,但是电极会受到蛋白的吸附污染,自身灵敏度下降,造成测量的结果出现偏差。基于此,Mao等[17]在电极表面进行了一系列的修饰,实现了电极极强的抗污染性能,使电极体外灵敏度与植入检测中的灵敏度相比不会出现较大改变。例如,采用牛血清白蛋白预处理微电极,虽然会损失电极在体外测试的部分灵敏度,但是保证了电极体外与体内灵敏度校正的一致性,使校正数据更加可信,保证了电极对多巴胺浓度检测的准确性,也降低了电极校正的难度。此外,Mao等[18]后续通过在电极上电沉积修饰亲水性的磷酸胆碱高分子(PEDOT-PC)膜层,不仅进一步提高了植入电极的抗污染性能,而且也不会对电极的灵敏度造成影响,使电极在体内检测时多与多巴胺检测信号具有良好的灵敏度,该电极对于KCl局部注射以及电刺激过程中导致的多巴胺信号变化具有显著的响应,有望用于更多生理及病理过程中多巴胺浓度变化的精准检测。
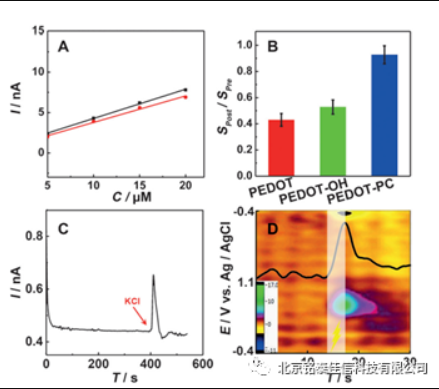
图 2、抗污染电极用于脑内检测多巴胺浓度变化(A) 电极体内及体外灵敏度对比;(B) 修饰不同抗污染层对电极灵敏度的影响;(C)SD 大鼠 KCl 刺激多巴胺释放过程;(D)SD大鼠电刺激多巴胺释放过程
参考文献:
[1]Clark L C, Misrahy G, Fox R P. J. Appl. Physiol., 1958, 13(1): 85-91.
[2] Kissinger P T,Hart J B, Adams R N. Brain Res., 1973, 55(1): 209-213.
[3] Rodeberg N T,Sandberg S G, Johnson J A, et al. ACS Chem. Neurosci., 2017, 8(2):221-234.
[4] Howell J O,Kuhr W G, Ensman R E, Wightman R M. J. Electroanal. Chem., 1986, 209(1) : 77-90.
[5] Venton B J,Wightman R M. Anal. Chem., 2003, 75(19): 414A-421A.
[6] Bath B D,Michael D J, Trafton B, et al. Anal. Chem., 2000, 72(24): 5994 -6002.
[7] Millar J,O'Connor J J, Trout S J, Kruk Z L. J. Neurosci. Methods, 1992, 43(2-3): 109-118.
[8] Keithley R B,Takmakov P, Bucher E S, et al. Anal. Chem., 2011,83(9): 3563-3571.
[9] Michael D,Travis E R, Wightman R M. Anal. Chem., 1998, 70(17): 586A-592A.
[10].Heien M,Johnson M A, Wightman R M. Anal. Chem., 2004, 76(19): 5697-5704.
[11] Keithley R B,Wightman R M. ACS Chem. Neurosci., 2011, 2(9): 514-525.
[12] Keithley R B,Heien M L, Wightman R M. TrAC-Trends Anal. Chem., 2009, 28(9): 1127-1136.
[13] Heien M, KhanA S, Ariansen J L, Cheer J F, Phillips P E M, Wassum K M, Wightman R M. Proc.Natl. Acad. Sci. USA, 2005, 102(29): 10023-10028.
[14] Clark J J,Sandberg S G, Wanat M J, Gan J O, Horne E A, Hart A S, Akers C A, Parker J G,Willuhn I, Martinez V,Evans S B, Stella N, Phillips P E M. Nat. Methods, 2010,7(2): 126-132.
[15] Schwerdt H N,Shimazu H, Amemori K I, Amemori S, Tierney P L, Gibson D J, Hong S, Yoshida T,Langer R, Cima M J, Graybiel A M. Proc. Natl. Acad. Sci. USA, 2017, 114(50): 13260-13265.
[16] Yi-Fei X,Tong-Fang X, Ya-Nan J, et al. Chinese J Anal Chem, 2019, 47(10):1443-1454.
[17] Liu, X.,Zhang, M., Xiao, T., Hao, J., Li, R., Mao, L. Anal Chem, 2016, 88(14):7238-7244.
[18] Liu, X., Xiao,T., Wu, F., Shen, M., Zhang, M., Yu, H., Mao, L. Angew. Chem,. 2017, 56(39):11802-11806.