
服务热线

应激性高血糖与“战斗-逃跑”行为密切相关,杏仁核负责协调应对威胁的行为适应,但它在调控代谢适应(例如能量分配)中的作用仍有待探索。
近日,西奈山伊坎医学院的研究人员在国际顶尖学术期刊Nature上发表了题为:“Amygdala–liver signalling orchestrates glycaemic responses to stress”的研究论文。该研究揭示了一个大脑-肝脏回路,首次将应激压力与血糖升高和2型糖尿病联系起来。应激压力会激活内侧杏仁核,导致肝脏生成过多葡萄糖,长期的血糖升高会导致高血糖,增加2型糖尿病患病风险。这一发现表明杏仁核还控制着血糖,有助于解释压力与2型糖尿病之间的关联,也为糖尿病的防治开辟了新途径。

1、急性应激快速改变代谢
以C57Bl/6小鼠为对象,探究应激相关代谢适应机制。急性束缚应激(30min)使禁食6h或自由摄食小鼠的血糖迅速升高、葡萄糖耐量受损,同时血浆皮质酮、胰高血糖素、肾上腺素及甘油水平升高,但胰岛素及去甲肾上腺素无显著变化。同时束缚应激在短时间内即可增强肝脏产糖能力,社交应激会抑制摄食,表明身体和社交应激可快速调动糖调节机制。
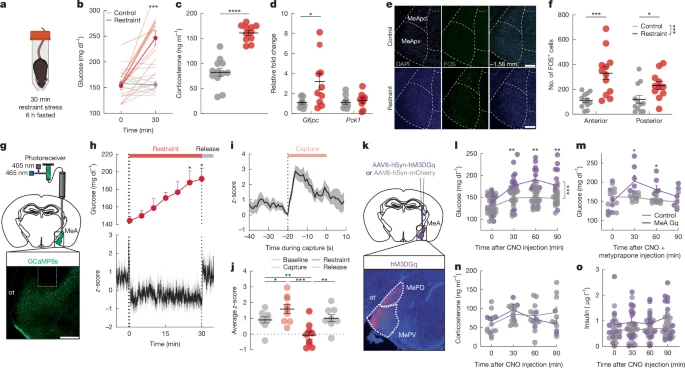
图1 MeA神经元的应激激活或能调节葡萄糖的水平
2、压力激活MeA神经元
免疫荧光实验发现急性束缚应激后MeA脑区激活的神经元数量显著增多。光纤钙成像表明,MeA神经元在“捕捉期”即迅速兴奋,其峰值早于血糖上升;而在30min束缚期,神经元活动反而下降,释放后恢复至基线,急性应激引起MeA脑区钙离子活性显著升高且发生在血糖水平升高之前。足部电击与视觉威胁同样快速激活MeA并升高血糖,但新奇环境或自发运动不引起MeA活动变化。
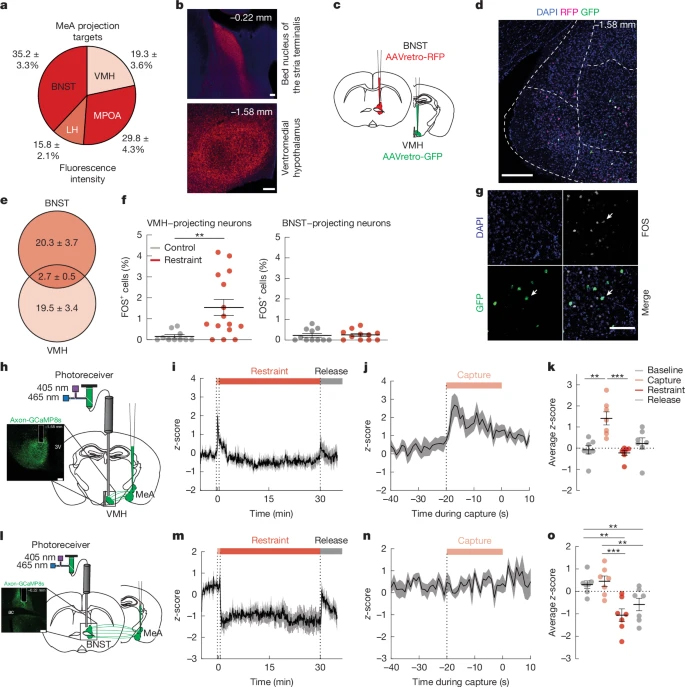
图2 急性束缚应激可激活MeA→VMH神经元,但不能激活MeA→BNST神经元
3、化学遗传/光遗传激活MeA调节葡萄糖和摄食
通过化学遗传学和光遗传学技术探究MeA在应激代谢适应中的作用。化学遗传学中,向小鼠MeA注射含兴奋性hM3D(Gq),腹腔注射CNO激活MeA后,可在非应激小鼠中迅速升高血糖,并抑制禁食小鼠1h内摄食及饱食小鼠2h内奖赏摄食,但不影响焦虑恐惧行为。光遗传学中,注射含ChR2的病毒,光刺激激活MeA,获得一致结果。揭示急性应激源可激活MeA神经元,驱动高血糖与摄食抑制。
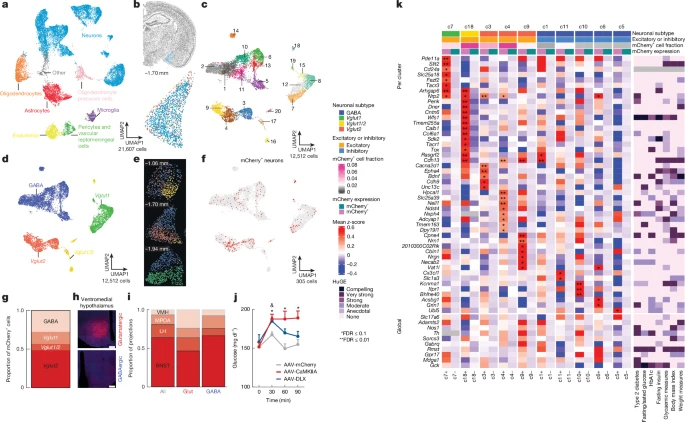
图3 VMH投射MeA神经元的基因表达
4、MeAVMH的神经元调节血糖
探究MeA神经元调控血糖和食欲的环路机制,发现MeA神经元轴突末梢密集分布于MeA纤维密集投射至VMH、BNST、外侧下丘脑(LH)及内侧视前区(MPOA)。通过逆行病毒追踪,确认投射到VMH(MeAVMH)和BNST(MeABNST)的MeA神经元群体基本不重叠,提示两群神经元基本独立。实验进一步证实,急性束缚应激优先激活MeAVMH神经元;光纤记录MeAVMH轴突钙信号在捕捉期显著升高且早于血糖上升;化学遗传激活MeAVMH神经元可升高血糖并延缓葡萄糖耐量恢复;化学遗传抑制MeAVMH神经元则显著削弱急性和重复应激所致的高血糖。而MeABNST神经元在以上应激下无明显变化。提示MeAVMH神经元是应激代谢适应的关键环路节点。
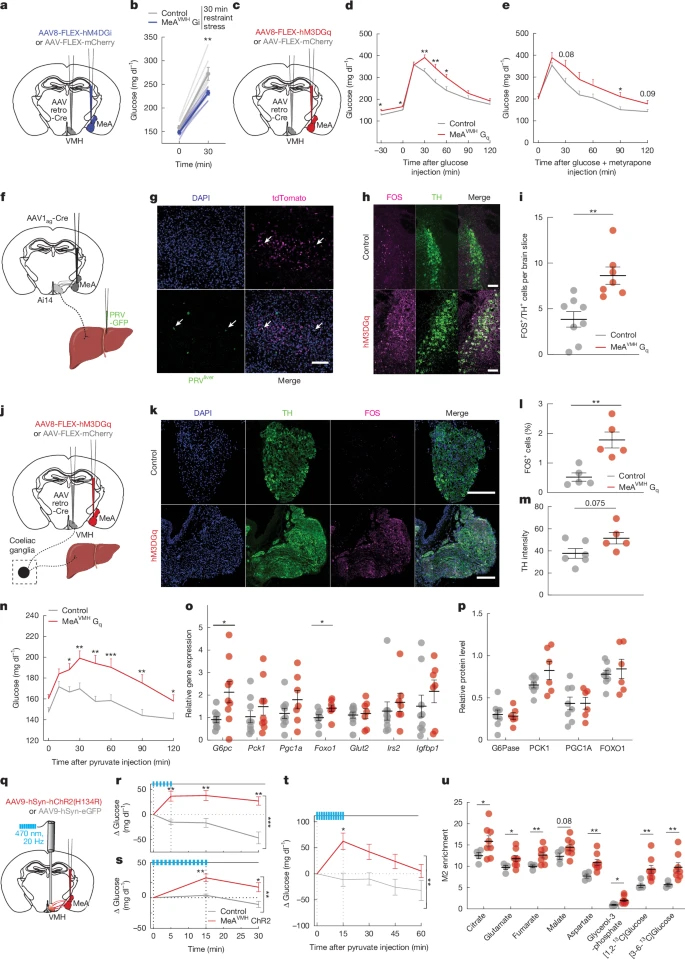
图4 投射到VMH的MeA神经元可调节血糖
5、调节葡萄糖的MeA-肝回路
通过病毒示踪,提示MeA→VMH→肝脏多突触通路存在。激活MeAVMH神经元显著增强交感神经枢纽(蓝斑核、腹腔神经节)的活性。丙酮酸耐量实验(PTT)显示,化学或光遗传激活MeAVMH可在非应激小鼠中迅速升高血葡萄糖,并增加肝脏G6pc、Foxo1等糖异生基因表达;抑制MeAVMH神经元则削弱应激诱导的糖异生相关基因表达变化。稳定同位素标记实验则证实,激活MeAVMH神经元会增加糖异生中间产物及葡萄糖的13C-葡萄糖的富集度。上述结果说明,MeA-肝脏环路可通过增强肝脏糖异生调控血糖。
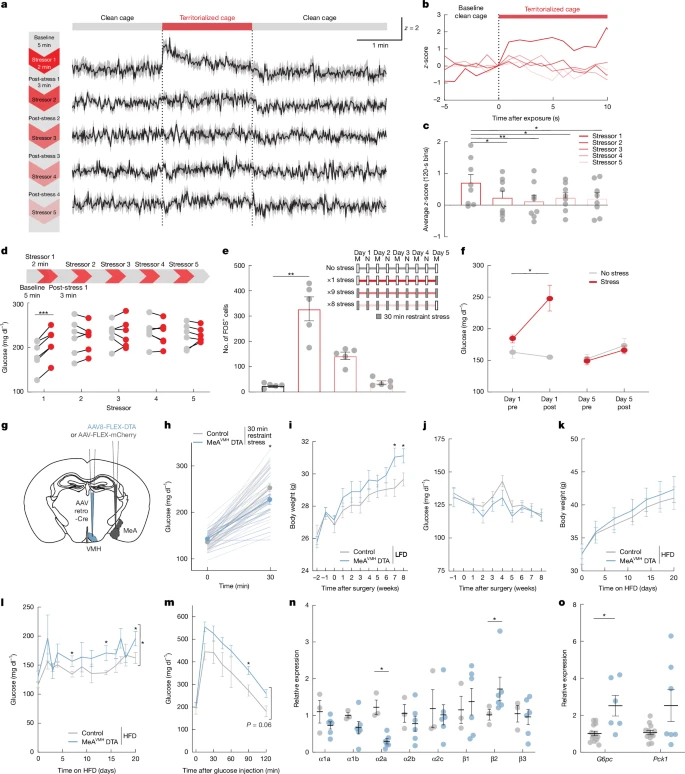
图5 慢性应激导致的MeA→VMH神经元激活钝化会促进体重增加和高血糖。
6、反复应激导致MeA-肝脏通路“疲劳”并诱发慢性高血糖
探究反复应激对MeA调控血糖的影响,发现小鼠经首次领地笼或束缚应激后,可显著升高血糖并激活MeA及MeAVMH神经元,对后续应激的活性反应钝化,应激诱导的高血糖效应也减弱,提示神经反应快速适应。利用DTA清除MeAVMH神经元后,小鼠对急性应激的升糖反应减弱,在高脂喂养下清除该神经元的小鼠肝脏肾上腺素能受体表达异常,糖异生基因表达升高,出现血糖升高、糖耐受损,且标准饲料喂养时体重也增加。该结果提示,MeAVMH神经元缺失导致体重增加、血糖异常等代谢问题的风险发生。
结论
这项研究揭示了一条杏仁核-肝脏信号轴,它不仅调控应激压力下的快速血糖适应,还将反复应激与代谢功能障碍直接关联。这些发现有助于临床医生能够更好地理解压力与血糖调控之间的关联机制,为开发有助于降低糖尿病风险并改善糖尿病患者(尤其是压力水平较高的患者)血糖控制的治疗方法开辟了新途径。
实验延展
根据此项研究,大脑杏仁核(MeA)→下丘脑(VMH)→肝脏这条新通路可独立调控应激性高血糖。随之而来的关键问题是:该通路中神经元之间依靠哪些化学物质(如神经递质或调质)进行通信?

北京铭泰佳信科技有限公司自主研发的活体脑化学物质实时分析系统,能够实时捕捉脑内多种化学物质的动态变化,例如多巴胺、葡萄糖、乳酸、抗坏血酸、pH、钾离子、钙离子等。该系统可与文章中使用的光遗传、化学遗传等技术相结合,从而显著拓展研究的深度和广度。通过将脑化学物质实时分析系统与上述技术联用,研究可实现从“观测神经活动”到“解析分子机制”的跨越——不仅明确MeA→VMH通路是否活跃,更进一步揭示其依赖的化学信号基础。
这种神经环路研究与生理功能分析的融合,为理解大脑如何精确调控身体机能提供了更全面的视角。
论文链接:
www.nature.com/articles/s41586-025-09420-1